Alleenpaar
In die chemie verwys 'n alleenpaar (of soms 'n alleenelektronpaar) na 'n paar valenselektrone wat nie met 'n ander atoom in 'n kovalente binding gedeel word nie[1] en word soms 'n ongedeelde of nie-bindende paar genoem. Alleenpare word in die buitenste elektronskil van atome aangetref. Hulle kan geïdentifiseer word deur 'n Lewis-struktuur te gebruik. Elektronpare word dus as alleenpare beskou as twee elektrone gekoppel is, maar nie in chemiese binding gebruik word nie. Dus, die aantal alleenpaar-elektrone plus die aantal bindingselektrone is gelyk aan die totale aantal valenselektrone rondom 'n atoom.

'n Enkele alleenpaar kan gevind word met atome in die stikstofgroep soos stikstof in ammoniak. Twee alleenpare kan gevind word met atome in die kalkogeengroep[Nota 1] soos suurstof in water. Die halogene kan drie alleenpare dra soos in waterstofchloried.
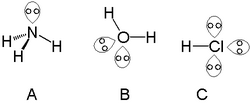
Die alleenpaar-konsep word gebruik in valensskil-elektronpaar-afstotingsteorie (VSEPA-teorie) wat die vorms van molekules verduidelik. Daar word ook na hulle verwys in die chemie van Lewis-sure en -basisse. Nie alle nie-bindende elektronpare word deur chemici beskou as alleenpare nie. Voorbeelde hiervan is die oorgangsmetale waar die nie-bindende pare nie die molekulêre meetkunde beïnvloed nie en dus stereochemies onaktief is. In die molekulêre orbitale-teorie is die konsep van 'n alleenpaar minder onderskeidend, aangesien die ooreenstemming tussen 'n orbitaal en komponente van 'n Lewis-struktuur dikwels nie eenvoudig is nie. Nietemin word besette nie-bindende orbitale (of orbitale met meestal nie-bindende karakter) gereeld geïdentifiseer as alleenpare. Berekeningskriteria vir die aanwesigheid van alleenpare gebruik afgeleides van die elektrondigtheid, elektrostatiese potensiaal of die elektronlokaliseringsfunksie.[2]
In die VSEPA-teorie vorm die elektronpare op die suurstofatoom in water die hoekpunte van 'n tetraëder met die alleenpare op twee van die vier hoekpunte. Die H-O-H-bindingshoek is 104,5°, minder as die 109° wat vir 'n tetraëdriese hoek voorspel word, en dit kan verklaar word deur 'n afstootlike wisselwerking tussen die alleenpare.[3][4][5] In teenstelling, in koolstofdioksied (met geen alleenpare nie) is die elektrone almal betrokke by binding en die molekule is lineêr met suurstofatome aan weerskante van die koolstofatoom.
|
Aantekeninge wysig
- ↑ Die kalkogeengroep is groep 16 van die Periodieke tabel en sluit suurstof (O), swawel (S), selenium (Se), tellurium (Te) en polonium (Po) in. Die chemies-ongekarakteriseerde sintetiese element livermorium (Lv) word voorspel om deel uit te maak van hierdie groep.
Verwysings wysig
- ↑ "lone (electron) pair (L03618)". IUPAC.org (in Engels). 24 Februarie 2014. Besoek op 5 Mei 2021.
- ↑ Kumar, Anmol; Gadre, Shridhar R.; Mohan, Neetha; Suresh, Cherumuttathu H. (16 Januarie 2014). "Lone Pairs: An Electrostatic Viewpoint". The Journal of Physical Chemistry A (in Engels). 118 (2): 526–532. Bibcode:2014JPCA..118..526K. doi:10.1021/jp4117003. ISSN 1089-5639. PMID 24372481.
- ↑ Fox, M.A.; Whitesell, J.K. (2004). Organic Chemistry (in Engels). Jones and Bartlett Publishers. ISBN 978-0-7637-2197-8.
- ↑ McMurry, J. (2000). Organic Chemistry (5de uit.) (in Engels). Ceneage Learning India Pvt Limited. ISBN 978-81-315-0039-2.
- ↑ Lee, J.D. (1968). Concise Inorganic Chemistry. Student's paperback edition (in Engels). Van Nostrand.

