Fosforsuur: Verskil tussen weergawes
Nuwe artikel |
(Geen verskil)
|
Wysiging soos op 14:33, 28 November 2017
Fosforsuur is 'n belangrike chemiese produk wat veral in die kunsmisnywerheid gebruik word. Dit word berei uit fosforertse deur die inwerking van swaelsuur. Afhangend van die hoeveelheid swaelsuur wat gebruik word, word verskillende kaliumsoute uit fosforsuur gevorm. Naas die gebruik daarvan in die kunsmisnywerheid is fosforsuur ook belangrik as beitssuur by die oppervlakbehandeling van metale, waterversagter en roesverwyderaar en vir nywerheidsgebruik in dranke en limonades.
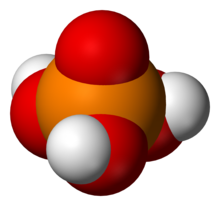
Die korrekte naam vir fosforsuur ('n driebasiese suur met 'n smeltpunt van 42°C en 'n soortlike gewig van 1.884) is ortofosforsuur (H3P04), ter onderskeiding van 'n groot aantal ander bekende fosforsure. 'n Verbinding met die samestelling 2H3P04.H20 is in 'n kristallyne vorm bekend. By verhitting verloor (orto-) fosforsuur water en gaan eers oor in piro- (H4P20 7) en vervolgens oor in metafosforsuur (HP03), waarin fosfor vrywaardig is en wat soute (met ander woorde die fosfate) vorm.
Fosforsuur is 'n swakker suur as soutsuur of swaelsuur, maar werk tog etsend in op die vel. Dit kan by verhitting selfs glas en keramiek aantas. Omdat dit nie giftig is vir inwendige gebruik nie en in 'n verdunde vorm 'n prikkelende smaak het, word fosforsuur in dranke en limonades gebruik.
Fosforsuur of fosfate is essensieel in die voeding van plante en diere. Dit word byvoorbeeld in die vorm van soutlekke as veebyvoer gebruik. Deur die toevoeging van fosforhoudende kunsmis kan die grond se vrugbaarheid baie verbeter word.
Die grootste fabriek in Suid-Afrika waar fosforsuur berei word, is in Richardsbaai. Die apatiet word met swaelsuur behandel en lewer dan hidrofluoorsuur, kalsiumfosfaat en fosforsuur in 'n stroperige vloeistof (wat nie heeltemal suiwer is nie). Superfosfaat, dubbelfosfaat en ammoniumfosfaat
As die apatietrots met verdunde swaelsuur behandel word, word nie fosforsuur nie, maar wel Ca(H2P04)2 gevorm. Hierdie verbinding is die hoofbestanddeel van die kunsmisstof superfosfaat, wat egter ook nog CaS04, fosfaaterts en kalsiumfluoried kan bevat. Dubbelsuperfosfaat is 'n suiwerder vorm van Ca(H 2 P04)2 as superfosfaat en word berei deur kleiner hoeveelhede apatiet met fosforsuur en 'n swak konsentrasie swaelsuur te behandel.
Nog 'n belangrike kunsmisstof (ammoniumfosfaat) wat stikstof aan die grond voorsien, word berei deur superfosfaat en dubbelsuperfosfaat met ammoniak en fosforsuurte behandel. AI bogenoemde soute is in so 'n mate oplosbaar dat plante dit kan opneem. Suiwer fosforsuur word deur oksidasie en die reaksie met water uit fosfor berei. Die suiwer verbinding is kristallyn en smelt by 315 K (digtheid 1,83).
Bronnelys
- Wêreldspektrum, Volume 7, bl.49, ISBN 090840941 9