Proteïen-invouing
Proteïen-invouing is die fisiese proses by wyse waarvan 'n proteïenketting sy natuurlike driedimensionele struktuur verkry. Dit is 'n konformasie wat gewoonlik biologies funksioneel is, en op 'n spoedige en reproduseerbare wyse plaasvind. Dit is die fisiese proses waardeur polipeptiede 'invou' in die karakteristieke en funksionele 3-dimensionele vorm daarvan vanaf 'n lukrake lus.[1] Elke proteïen bestaan as 'n on-gevoude polipeptied of lukrake lussie wanneer dit van 'n sekwensie van mRNS biologies 'geïnterpreteer' of 'vertaal' word na 'n lineêre ketting van aminosure. Hierdie polipeptiede beskik nie oor enige stabiele (langdurige) driedimensionele struktuur nie (die linkerkant van die eerste figuur). Soos wat die polipeptiedketting gesintetiseer word deur 'n ribosoom, begin die lineêre ketting om in te vou in sy driedimensionele struktuur. Die invouing begin reeds tydens die 'interpretasie' of 'vertaling' van die polipeptiedketting. Aminosure reageer met mekaar om 'n goed gedefinieerde 3-dimensionele struktuur te vorm, d.i. die gevoude proteïen (die regterkant van die figuur), wat bekend staan as die normale toestand. Die gevolglike 3-dimensionele struktuur word bepaal deur die aminosuurvolgorde of primêre struktuur (Anfinsen se dogma).[2]
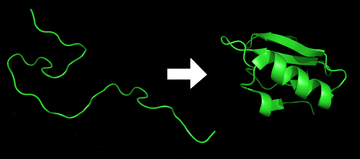

Die korrekte 3-dimensionele struktuur is essensieel vir funksionering, alhoewel sommige dele van funksionele proteïene nie-gevou mag bly,[3] sodat proteïendinamika belangrik is. Versuim om in die natuurlike struktuur in te vou, produseer oor die algemeen onaktiewe proteïene, maar in sommige gevalle beskik foutiewelik gevoude proteïene oor gewysigde of 'toksiese' funksies. Daar word vermoed dat verskeie senuwee-degeneratiewe en ander siektes die gevolg is van die ophoping van amiloïde fibrille wat gevorm word deur foutiewelik gevoude proteïene.[4] Baie allergieë word veroorsaak deur die inkorrekte invouing van sommige proteïene omdat die immuunstelsel nie teenliggame kan produseer vir sekere proteïenstrukture nie.[5]
Denaturasie van proteïene is 'n oorgangsproses van die gevoude na die nie-gevoude (lukrake lussie) voorkoms of toestand. Dit gebeur wanneer iets gekook of gebrand word, in proteïenopatie, asook in ander kontekste.
Die tydsduur van die vouproses wissel dramaties afhangende van die proteïen. As die proses buite die sel bestudeer word, benodig die proteïene wat die stadigste vou, baie minute of ure om te vou, hoofsaaklik as gevolg van Cis-trans isomerisasie, en moet dit dus deur 'n aantal intermediêre toestande gaan, byna soortgelyk aan kontrolepunte, voordat die proses voltooi is.[6] Aan die ander kant word baie klein enkel-domein proteïene met 'n lengte van tot honderd aminosure tipies in 'n enkele stap gevou.[7] Tydskale van millisekondes is die norm; die vinnigste bekende proteïenvou-reaksies word binne enkele mikrosekondes voltooi.[8]
Proteïen-invouingsproses
wysigPrimêre struktuur
wysigDie primêre struktuur van 'n proteïen, dit wil sê sy lineêre aminosuursekwensie, bepaal die gebruiklike bouvorm daarvan.[9] Die spesifieke aminosuur reste en die posisie daarvan in die polipeptiedketting is die bepalende faktore ten opsigte waarvan gedeeltes van die proteïen nou saamvou en die kenmerkende driedimensionele bouvorm (konformasie) vorm. Die aminosuursamestelling is nie so belangrik soos die sekwensie oftewel ry nie.[10] Die wesenlike feit van invouing blyk egter te wees dat die aminosuurvolgorde of - sekwensie van elke proteïen die inligting bevat wat die gebruiklike of normale struktuur spesifiseer, sowel as die wyse waarop daardie toestand bereik word. Dit is egter nie te sê dat byna identiese aminosuurvolgordes of - sekwensies altyd op soortgelyke wyse vou nie.[11] Bouvorme verskil ook op grond van omgewingsfaktore; soortgelyke proteïene vou verskillend, afhangende van waar hulle aangetref word.
Sekondêre struktuur
wysigDie vorming van 'n sekondêre struktuur is die eerste stap in die vouproses wat 'n proteïen neem om sy natuurlike of gebruiklike struktuur aan te neem. Kenmerkend van sekondêre strukture is die strukture wat bekendstaan as alfa-helikse en beta plate wat vinnig vou omdat dit gestabiliseer word deur intramolekulêre waterstofbindings, soos dit die eerste keer bevind is deur Linus Pauling. Die vorming van intramolekulêre waterstofbindings lewer nog 'n belangrike bydrae tot proteïenstabiliteit.[12] α-helikse word gevorm deur die waterstofbinding van die ruggraat ten einde 'n spiraalvorm te vorm (verwys na figuur aan die regterkant). [10] Die ß-geplooide plaat is 'n struktuur wat vorm met die ruggraat wat oor homself buig om die waterstofverbindings te vorm (soos getoon in die figuur links). Die waterstofverbindings is tussen die amiedwaterstof en karboniel suurstof van die peptiedbinding. Daar bestaan anti-parallelle ß-geplooide plate en parallelle ß-geplooide plate waar die stabiliteit van die waterstofverbindings sterker is in die anti-parallelle ß-plaat, aangesien dit bind met die ideale 180°-hoek, in vergelyking met die skuins waterstofverbindings wat deur parallelle plate gevorm word.[10]
Tersiêre struktuur
wysigDie alfa-helikse en beta-geplooide plate kan amfipaties van aard wees, of 'n hidrofiliese gedeelte en 'n hidrofobiese gedeelte bevat. Hierdie eienskap van sekondêre strukture help met die tersiêre struktuur van 'n proteïen waarin die vou plaasvind, sodat die hidrofiliese sye teenoor die waterige omgewing rondom die proteïen is en die hidrofobiese sye teenoor die hidrofobiese kern van die proteïen.[13] Die sekondêre struktuur maak op hiërargiese wyse plek vir tersiêre struktuurvorming of formasie. Sodra die proteïen se tersiêre struktuur gevorm is en gestabiliseer word deur hidrofobiese interaksies, mag daar ook kovalente binding wees in die vorm van disulfied-brûe wat tussen twee sisteïenreste gevorm word. Die tersiêre struktuur van 'n proteïen behels 'n enkele polipeptiedketting; bykomende interaksies van gevoude polipeptiedkettings lei egter tot die vorming van die kwaternêre strukture.[14]
Kwaternêre struktuur
wysigTersiêre strukture kan moontlik plek maak vir die vorming van kwaternêre strukture in sommige proteïene, wat meestal die "samestelling" of "mede-samestelling" van sub-eenhede behels wat reeds gevou is; met ander woorde, veelvuldige polipeptiedkettings kan in wisselwerking tree om 'n ten volle funksionele kwaternêre proteïen te vorm.[10]
Verwysings
wysig- ↑ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walters, Peter (2002). "The Shape and Structure of Proteins". Molecular Biology of the Cell; Fourth Edition. New York and London: Garland Science. ISBN 978-0-8153-3218-3.
{{cite book}}: Onbekende parameter|chapterurl=geïgnoreer (hulp); Onbekende parameter|name-list-format=geïgnoreer (hulp) - ↑ Anfinsen CB (Julie 1972). "The formation and stabilization of protein structure". The Biochemical Journal. 128 (4): 737–49. doi:10.1042/bj1280737. PMC 1173893. PMID 4565129.
- ↑ Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert (2002). "3. Protein Structure and Function". Biochemistry. San Francisco: W. H. Freeman. ISBN 978-0-7167-4684-3.
{{cite book}}: Onbekende parameter|chapterurl=geïgnoreer (hulp) - ↑ Selkoe DJ (Desember 2003). "Folding proteins in fatal ways". Nature. 426 (6968): 900–4. Bibcode:2003Natur.426..900S. doi:10.1038/nature02264. PMID 14685251.
- ↑ Alberts, Bruce; Bray, Dennis; Hopkin, Karen; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2010). "Protein Structure and Function". Essential cell biology (Third uitg.). New York, NY: Garland Science. pp. 120–70. ISBN 978-0-8153-4454-4.
- ↑ Kim PS, Baldwin RL (1990). "Intermediates in the folding reactions of small proteins". Annual Review of Biochemistry. 59: 631–60. doi:10.1146/annurev.bi.59.070190.003215. PMID 2197986.
- ↑ Jackson SE (1998). "How do small single-domain proteins fold?". Folding & Design. 3 (4): R81-91. doi:10.1016/S1359-0278(98)00033-9. PMID 9710577.
- ↑ Kubelka J, Hofrichter J, Eaton WA (Februarie 2004). "The protein folding 'speed limit'". Current Opinion in Structural Biology. 14 (1): 76–88. doi:10.1016/j.sbi.2004.01.013. PMID 15102453.
- ↑ Anfinsen CB (Julie 1973). "Principles that govern the folding of protein chains". Science. 181 (4096): 223–30. Bibcode:1973Sci...181..223A. doi:10.1126/science.181.4096.223. PMID 4124164.
- ↑ 10,0 10,1 10,2 10,3 Voet, Donald; Voet, Judith G.; Pratt, Charlotte W. (2016). Principles of Biochemistry (Fifth uitg.). Wiley. ISBN 978-1-118-91840-1.
{{cite book}}: Onbekende parameter|name-list-format=geïgnoreer (hulp) - ↑ Alexander PA, He Y, Chen Y, Orban J, Bryan PN (Julie 2007). "The design and characterization of two proteins with 88% sequence identity but different structure and function". Proceedings of the National Academy of Sciences of the United States of America. 104 (29): 11963–8. Bibcode:2007PNAS..10411963A. doi:10.1073/pnas.0700922104. PMC 1906725. PMID 17609385.
- ↑ Rose GD, Fleming PJ, Banavar JR, Maritan A (November 2006). "A backbone-based theory of protein folding". Proceedings of the National Academy of Sciences of the United States of America. 103 (45): 16623–33. Bibcode:2006PNAS..10316623R. CiteSeerX 10.1.1.630.5487. doi:10.1073/pnas.0606843103. PMC 1636505. PMID 17075053.
- ↑ Fersht, Alan (1999). Structure and Mechanism in Protein Science: A Guide to Enzyme Catalysis and Protein Folding. Macmillan. ISBN 978-0-7167-3268-6.
{{cite book}}: Onbekende parameter|name-list-format=geïgnoreer (hulp) - ↑ "Protein Structure". Scitable (in Engels). Nature Education. Geargiveer vanaf die oorspronklike op 31 Oktober 2019. Besoek op 26 November 2016.
Eksterne skakels
wysig- Wikimedia Commons het meer media in die kategorie Proteïen-invouing.
- FoldIt - Folding Protein Game
- Folding@Home
- Rosetta@Home
- Human Proteome Folding Project
- BHAGEERATH-H: Protein tertiary structure prediction server
| Hierdie artikel is in sy geheel of gedeeltelik vanuit die Engelse Wikipedia vertaal. |