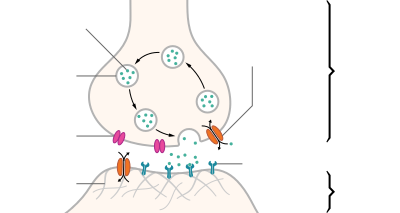
Reseptor (biochemie)
’n Reseptor in biochemie en farmakologie is ’n proteïenmolekule wat chemiese seine van ’n ander sel ontvang.[1] Wanneer sulke chemiese seine aan ’n reseptor bind, veroorsaak hulle die een of ander vorm van weefsel-/sellulêre reaksie, byvoorbeeld ’n verandering in die sel se elektriese aktiwiteit.
| Reseptor |
|---|

In hierdie sin is ’n reseptor ’n proteïenmolekule wat interne chemiese seine herken en daarop reageer – ’n asetielcholien-reseptor herken byvoorbeeld sy interne ligand, asetielcholien. Soms word die term in farmakologie ook gebruik om ander proteïene in te sluit wat dwelmteikens is.
Reseptorproteïene kan geklassifiseer word volgens hul ligging. Transmembraanreseptore sluit in ioonkanaalgebonde (ionotropiese) reseptore, G-proteïengebonde (metabotropiese) hormoonreseptore en ensiemgebonde hormoonreseptore.[1] Intrasellulêre reseptore is dié wat in die sel voorkom en sluit in sitoplasmiese en kernreseptore.[1] ’n Molukule wat aan ’n reseptor bind, word ’n ligand genoem; dit kan ’n proteïn, peptied of ander klein molekule wees soos ’n senuoordraer, hormoon, farmaseutiese dwelm, gifstof of dele van die buitekant van ’n virus of mikrobe. Die intern aangewese molekule vir ’n spesifieke reseptor word sy interne ligand genoem.
Elke reseptor is gebonde aan ’n spesifieke sellulêre biochemiese pad. Hoewel verskeie reseptore in die meeste selle voorkom, sal elke reseptor net bind met ligande met ’n sekere struktuur, amper soos wat slegs ’n sleutel met ’n sekere vorm in ’n spesifieke slot sal pas. Wanneer ’n ligand met sy ooreenstemmende reseptor bind, aktiveer of inhibeer dit die reseptor se geassosieerde biochemiese pad.
Struktuur
wysigReseptore se struktuur is baie uiteenlopend en kan oor die algemeen in die volgende kategorieë ingedeel word:
- Tipe 1: L (ionotropiese reseptore) – gewoonlik die teikens van vinnige senuoordraers soos asetielcholien (nikotinies) en gamma-aminobottersuur (GABA); hul aktivering lei tot veranderings in ioonbeweging oor ’n membraan. Hulle het ’n heteromeriese struktuur in die sin dat elke ondereenheid bestaan uit die ekstrasellulêre ligandbindingsdomein en ’n transmembraandomein, waar laasgenoemde weer vier transmembraan-alfahelikse insluit. Die ligandbindingsholtes lê tussen die ondereenhede.
- Tipe 2: G-proteïengekoppelde reseptore (metabotropies) – die grootste groep reseptore; sluit in die reseptore vir verskeie hormone en stadige senuoordraers soos dopamien. Hulle is saamgestel uit sewe transmembraan-alfahelikse. Die lusse wat die alfahelikse verbind, vorm ekstra- en intrasellulêre domeine. Die bindingsplek vir groter peptiedligande is gewoonlik geleë in die ekstrasellulêre domein en die bindingsplek vir kleiner niepeptiedligande tussen die sewe alfahelikse en een ekstrasellulêre lus.[2] Die bogenoemde reseptore is gekoppel aan verskillende intrasellulêre effektorstelsels via G-proteïene.[3]
- Tipe 3: Kinasegekoppelde en verwante reseptore – saamgestel uit ’n ekstrasellulêre domein, wat die ligandbindingsplek bevat, en ’n intrasellulêre domein. ’n Voorbeeld is die insulienreseptor.
- Tipe 4: Kernreseptore – ondanks hul naam lê hulle eintlik in die sitoplasma, en migreer na die selkern nadat hulle met hul ligande gebind het. Hulle is saamgestel uit ’n C-terminaal-ligandbindingstreek, ’n kern-DNS-bindingsdomein en ’n N-terminaaldomein wat die AF1(aktiveringsfunksie 1)-streek bevat.
Verwysings
wysig- ↑ 1,0 1,1 1,2 Hall, JE (2016). Guyton and Hall Textbook of Medical Physiology. Philadelphia, PA: Elsevier Saunders. pp. 930–937. ISBN 978-1-4557-7005-2.
- ↑ Congreve M, Marshall F (Maart 2010). "The impact of GPCR structures on pharmacology and structure-based drug design". Br. J. Pharmacol. 159 (5): 986–96. doi:10.1111/j.1476-5381.2009.00476.x. PMC 2839258. PMID 19912230.
- ↑ Kou Qin, Chunmin Dong, Guangyu Wu & Nevin A Lambert (Augustus 2011). "Inactive-state preassembly of Gq-coupled receptors and Gq heterotrimers". Nature Chemical Biology. 7 (11): 740–747. doi:10.1038/nchembio.642. PMC 3177959. PMID 21873996.
{{cite journal}}: AS1-onderhoud: meer as een naam (link)
Eksterne skakels
wysig- Hierdie artikel is vertaal uit die Engelse Wikipedia