Koper(I)chloried
Koper(I) chloried is 'n chloried van koper is sy +1 oksidasietoestand. Dit is 'n sout van koper en soutsuur met formule CuCl. Die stof kom in die natuur as die mineraal nantokiet voor.
|
Algemeen | |
|---|---|
| Naam | Koper(I)chloried |
 |
 |
| Chemiese formule | CuCl |
| Molêre massa | 99 [g/mol][1] |
| CAS-nommer | 7758-89-6[1] |
| Voorkoms | grys vastestof[1] |
| Reuk | Reukloos [1] |
| Fasegedrag | |
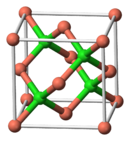
| Selkonstantes | a=542 pm.[2] |
| Ruimtegroep | F43m[2] |
| Nommer | 216 |
| Strukturbericht | B3 |
| Smeltpunt | 430 °C[1] |
| Kookpunt | 1490 °C[1] |
| Digtheid | 4,140[1] |
| Oplosbaarheid | sleg oplosbaar[1] |
| Ksp | 1,2 10-6[3] |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | nie-brandbaar |
| LD50 | 928-2000 [mg/kg][1] |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Suiwering
wysigIn suiwer vorm is dit 'n wit vastestof, maar blootgestel aan vog en suurstof verkleur dit groenerig deur die vorming van verbindings van Cu2+ soos Cu2Cl(OH)3 en CuCl2(H2O)2. Dit kan gesuiwer word deur herkristallisasie uit soutsuur. Dit los goed hierin op deur die vorming van 'n kompleks:[2]
Deur verdunning met water kan die gesuiwerde stof verkry word:
Eienskappe
wysigDie kristallyne materiaal is nie hard nie. Die Vickers-hardheid is 15,5 Die stof is 'n p-tipe halfgeleier met 'n taamlik groot direkte bandgaping (3,1 eV). Onder hierdie waarde is dit 'n baie deursigtige materiaal tot diep in die nabyinfrarooi gebied (2000 nm). Teen 25C is die geleidingsvermoë 8,05x10-8 Ω-1cm-1 Teen hoë frekwensies is die diëlektriese permitiviteit ε~20, maar onder 100 Hz neem dit skielik toe tot ~120.[2]
Strukture
wysigTeen kamertemperatuur kristalliseer koper(I)chloried in die kubiese sfaleriet-struktuur. Dit word die γ-fase genoem. [4]Teen hoër temperature (406 °C)[2] vind 'n faseoorgang na die β-fase plaas. Hierdie fase het die wurtziet-struktuur en baie hoë ioniese geleidingsvermoë van amper χ=0,01-0,1 Ω-1cm-1. By die smeltpunt van die β-fase (417 °C)[2] gaan die ioniese geleidingsvermoë omlaag. [4]
Verwysings
wysig- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 "MSDS". Fisher. Besoek op 24 Augustus 2023.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 Chenyue Yang, Yiyang Wen, Jianhui Xiong, Haichao Zhou, Shangke Pan, Hongbing Chen, Jianguo Pan (2022). "Crystal growth and photoelectric performance of γ-CuCl by the vertical Bridgman method". Journal of Crystal Growth. 579: 126463. doi:10.1016/j.jcrysgro.2021.126463.
{{cite journal}}: AS1-onderhoud: gebruik authors-parameter (link) - ↑ "Solubility Product Constants near 25 °C". University of Rhode Island.
- ↑ 4,0 4,1 Shabanov, O.M., Kachaev, R.T., Dzhamalova, S.A. (2010). "Wien effect in CuCl, CuBr and CuI superionic crystals and their melts". Russ J Electrochem. 46: 1390–1394. doi:10.1134/S1023193510120086.
{{cite journal}}: AS1-onderhoud: gebruik authors-parameter (link)