Nikkeltetrakarboniel
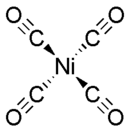
Nikkeltetrakarboniel of nikkelkarboniel is 'n organometaalverbinding tussen nikkel en koolstofmonoksied met chemiese formule Ni(CO)4.
|
Algemeen | |
|---|---|
| Naam | Nikkeltetrakarboniel |
 |
 |
| Chemiese formule | Ni(CO)4 |
| Molêre massa | 170,7 [g/mol][1] |
| CAS-nommer | 13463-39-3[1] |
| Voorkoms | vlugtige kleurlose vloeistof[1] |
| Reuk | Muwwe reuk[2] |
| Fasegedrag | |
| Selkonstantes | a=1084 pm @ -55°C[3] |
| Ruimtegroep | Pa3 |
| Nommer | 205 |
| Strukturbericht | D1₁ |
| Smeltpunt | -25 °C[1] |
| Kookpunt | 43 °C[1] |
| Digtheid | 1,32 at 17°C[2] |
| Oplosbaarheid | |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | <20°C [1] |
| Selfontbrandingspunt | 60 °C[1] |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Die stof is uiters vlugtig, toksies, kankerverwekkend, ontvlambaar en plofbaar. Dit word soms die vloeibare dood genoem.
Kristalstruktuur
wysigTeen lae temperature kristalliseer nikkeltetrakarboniel in die kubiese tin(IV)jodied-struktuur (D11 in die strukturbericht-klassifikasie.[4]
Eienskappe
wysigNikkelkarboniel is 'n molekulêre verbinding en sy molekules het 'n tetraëdriese vorm. Nikkel het 'n oksidasietoestand nul in hierdie verbinding. Dit word reeds teen 40° C uit nikkelmetaal en CO gevorm
En dit ontbind teen hoër temperature. Dit kan gebruik word om nikkel met 'n hoë suiwerheid te vervaardig en word gebruik in die raffinering van nikkelerts, die vorming van nikkelfilms en -bedekkings. Dit word ook as 'n katalisator in verskeie chemiese reaksies en in glasplatering gebruik.[2]
Nikkelkarbonieldamp se digtheid is amper vier maal so groot as die lug s'n. Dit los maklik op in die meeste organiese oplosmiddels, maar dit is amper onoplosbaar in water. Dit reageer stadig met sout- en swawelsuur en vinnig met salpetersuur of die halogene en vorm die ooreenkomstige nikkelsoute. Broomwater word gebruik om reste van die stof in chemiese opstellings te vernietig. [5]
Vervaardiging
wysigDaar is twee industriële prosesse vir die grootskaale vervaardiging van hierdie verbinding:[5]
- ‘n Proses by atmosferiese druk wat koolstofmonoksied oor nilkkelsulfied en varsgereduseerde nikkelmetaal lei. (VK)
- ’n Proses met CO onder hoë druk lei tot die vorming van albei nikkel- en ysterkarboniel. Die twee word deur destillasie geskei.
Verwysings
wysig- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 "nickel carbonyl". Inchem.
- ↑ 2,0 2,1 2,2 "Nickel carbonyl". Australiese regering. Geargiveer vanaf die oorspronklike op 28 September 2023. Besoek op 28 September 2023.
- ↑ JOSHUA LADELL, BENJAMIN POS, I. FANKUCHEN (1952). "The Crystal Structure of Nickel Carbonyl, Ni(CO)4*". Acta Cryst. 5: 795.
{{cite journal}}: AS1-onderhoud: gebruik authors-parameter (link) - ↑ "SnI4". Aflow.
- ↑ 5,0 5,1 Antonsen, D.H., Meshri, D.T. (2005). Nickel Compounds. In Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002/0471238961.1409031101142015.a01.pub2.
{{cite book}}: AS1-onderhoud: gebruik authors-parameter (link)