Asynsuur
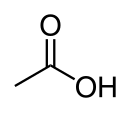
Asynsuur, ook bekend as etanoësuur, is 'n organiese chemiese verbinding, die meeste bekend vir die suur smaak in asyn en sy stekende reuk. Sy gekondenseerde struktuurformule word voorgestel as CH3COOH. Suiwer watervrye asynsuur is 'n kleurlose verbinding wat water uit die omgewing aantrek (higroskopies is), en benede 16,7 °C tot 'n kristal vries. Asynsuur is vretend en sy gas veroorsaak irritasie van die oë, 'n droog- en brandneus, 'n seer keel en vertering van die longe. Asynsuur word as 'n swak suur beskou omdat by standaard temperatuur en druk (STD) die gedissosieerde suur in ewewig is met die ongedissosieerde vorm in waterige oplossing, in teenstelling met sterk sure wat volledig gedissosieer is. Asynsuur is een van die eenvoudigste karboksielsure (die naaseenvoudigste ná mieresuur). Dit is 'n belangrike chemiese reagens en industriële chemikalie.
|
Algemeen | |
|---|---|
| Naam | Asynsuur |
| Sistematiese naam | etanoësuur |
 |
 |
| Chemiese formule | CH3COOH |
| Molêre massa | 60.05 g/mol |
| CAS-nommer | 64-19-7 |
| Voorkoms | kleurlose vloeistof |
| Reukdrempel | 0,074 dpm |
| Fasegedrag | |
| Smeltpunt | 16.5 °C (289.6 ± 0.5 K)[1] |
| Kookpunt | 118.1 °C (391.2 ± 0.6 K)[1] |
| Digtheid | 1.049 g cm−3, vloeistof; 1.266 g cm−3, vastestof |
| Mengbaarheid | water |
| Oplosbaarheid | |
|
Suur-basis eienskappe | |
| pKa | 4.76 by 25 °C |
|
Veiligheid | |
| Flitspunt | 43 °C |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Vervaardiging
wysigAsyn is tradisioneel uit wyn se alkohol verkry, maar daar is verskeie chemiese maniere om asynsuur te vervaardig en in die nywerheid word 'n paar daarvan toegepas. 'n Belangrike tussenproduk is asetaldehied wat met suurstof geoksideer kan word. Oplossings van asetaldehied wat 'n katalisator soos 0,5% mangaan-asetaat bevat, kan by 'n temperatuur van 55-80 °C en 5-6 Atm met die suurstof van die lug reageer volgens:[2]
Daar is nogtans ander prosesse soos die Monsanto-proses, wat uitgaan van metanol en koolstofmonoksied en 'n rodium-katalisator.
Voorbeeld: Bereken pH van suuroplossing
wysigBereken die pH van 'n 1.3 M oplossing van asynsuur (CH3COOH). (M staan vir mol/liter)
Ka = 1.8 × 105
In die algemeen:
- vir
Antwoord
Die dissosiasie reaksie vir CH3COOH is die volgende:
Die verandering in konsentrasie van elke element word in die tabel hieronder gewys:
| Beskrywing | Reagens | Produk 1 | Produk 2 |
|---|---|---|---|
| Algemene dissosiasiereaksie | |||
| Dissosiasiereaksie vir asynsuur | |||
| Begin konsentrasie [mol/liter] | 1.3 | 0 | 0 |
| Verandering in konsentrasie [mol/liter] | -x | x | x |
| Ewewigskonsentrasie [mol/liter] | 1.3-x | x | x |
Vanaf die algemene definisie vir :
Die algemene oplossing vir 'n kwadratiese vergelyking is die volgende:
Indien waardes vervang word, word die volgende verkry:
Dus is:
Onthou dat
Dus
Alternatiewelik kan die aanname gemaak word dat baie kleiner as 1 is omdat dit 'n swak suur is (Ka is klein, dus dissosieer die suur baie min). Dus . Dus:
Dus:
Kyk ook
wysigVerwysings
wysig- ↑ 1,0 1,1 "NIST" (in Engels). Geargiveer vanaf die oorspronklike op 17 November 2004.
- ↑ Acetic Acid and its Derivatives. Chemical Industries Victor H. Agreda CRC Press, 1992, ISBN 0824787927, ISBN 9780824787929
| C1 | C2 | C3 | C4 | C5 | C6 | |
| mieresuur | asynsuur | propioonsuur | bottersuur | valeriaansuur | kaproësuur | |
| C8 | C10 | C12 | C14 | C16 | C18 | C20 |
| kaprielsuur | kapriensuur | louriensuur | miristiensuur | palmitiensuur | steariensuur | aragiensuur |