Propeen
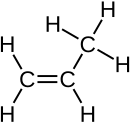
Propeen is 'n onversadigde drie-koolstofketting-alkeen met die molekulêre formule C3H6. Dit staan ook bekend as propileen of metieletileen, het een dubbelbinding en is die tweede eenvoudigste lid van die alkeenklas koolwaterstowwe. Dit is 'n kleurlose gas met 'n flou petroleumagtige reuk.[1] Propileen wat van hernubare materiale gemaak word, word Bio-propileen genoem.[2]
|
Algemeen | |
|---|---|
| Naam | Propeen |
| IUSTC-naam | Propeen |
| Ander name | Propileen Metieletileen |
 |
 |
| Chemiese formule | C3H6 |
| Molêre massa | 42,081 g/mol |
| CAS-nommer | 115-07-1 |
| Voorkoms | kleurlose gas |
| Fasegedrag | |
| Smeltpunt | -185.2 °C |
| Kookpunt | -47.6 °C |
| Digtheid | 1.81 kg/m3 (teen 15 °C en 101.3 kPa) |
| Oplosbaarheid | 0.61 g/m3 |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | −108 °C |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Voorkoms in die ruimte
wysigOp 30 September 2013 het NASA aangekondig dat die ruimtevaartuig Cassini, 'n deel van die Cassini-Huygens-missie, klein hoeveelhede natuurlik propeen wat natuurlik daar voorkom, in die atmosfeer van Titaan met behulp van spektroskopie ontdek het.[3]
Gebruike
wysigPropeen is die tweede belangrikste beginproduk in die petrochemiese industrie na etileen, met ongeveer 85 miljoen ton wat in 2013 gebruik is. Twee derdes van die propeen wat in die industrie gebruik word, word na polipropileen omgeskakel, en die res word meestal gebruik om propileenoksied, akrylnitril, komeen, butiraldehied, en akrielsuur te vervaardig. Polipropileen word gebruik in films, vesels, houers, verpakking, doppe, ens.[4]
Propeen word ook gebruik om isopropanol (propan-2-ol), akrilnitril, propileenoksied en epikloorhidrien te vervaardig.[5] In die industrie en werkswinkels word propeen gebruik as 'n alternatiewe brandstof vir asetileen vir die sweis en sny, soldeer en verhit van metaal.
Produksie
wysigDaar is drie hoof maniere waarop propeen geproduseer word: stoomkraak, olefienomskakeling en vloeistofkatalitiese kraak.
Stoomkraak
wysigDie heersende tegnologie vir die vervaardiging van propeen is stoomkraaking en is dieselfde tegnologie wat toegepas word om etaan na etileen te verander. Hierdie twee omskakelings is die twee grootste prosesse in die chemiese industrie, volgens hul skaal[6] en die proses is een van die mees energie-intensiewe industriële prosesse. In hierdie proses ondergaan propaan dehidrogenering en die opbrengs van propeen is ongeveer 85 m% met 'n neweproduk, waterstof:
- CH3CH2CH3 → CH3CH=CH2 + H2
Die grondstof is nafta of propaan en die propeen kan geskei word van die grondstowwe deur fraksionele distillasie.
Olefin-omskakeling
wysigIn die Phillips Olefin-omskakelingstegnologie word propileen onderling omgesit met etileen en 2-butene. Renium en molibdeen word as katalisators gebruik:[7]
- CH2=CH2 + CH3CH=CHCH3 → 2 CH2=CHCH3
Die tegnologie is gebaseer op 'n olefienmetatese-reaksie wat deur die Phillips Petroleum Company ontdek is[8][9] en propeen-opbrengste van ongeveer 90 m% word daarmee behaal.
'n Verwante proses is die metanol-na-olefiene / metanol-na-propeen prosese waarin sintetiese gas (sintesegas) na metanol omgeskakel word en dan word die metanol in etileen en / of propeen omgeskakel. Die proses produseer water as neweproduk. Sintesegas word vervaardig uit die reformasie van natuurlike gas of deur die stoom-geïnduseerde reformasie van petroleumprodukte soos nafta, of deur vergassing van steenkool. Sasol is aktief op die gebied by die produksie-aanleg vir sintetiese brandstof in Secunda.[10]
Vloeistofkatalitiese kraak
wysigVloeistofkatalitiese kraak word gebruik onder uiterste toestande (hoër katalisator-tot-olie-verhoudings, hoër stoominspuitingsnelhede, hoër temperature, ens.) om die hoeveelheid propeen en ander ligte produkte te maksimeer. Dit produseer ongeveer 20-25 m% propeen saam met groter volumes petrol en ander neweprodukte.[11]
Verbrandingsreaksies
wysigPropeen ondergaan verbrandingsreaksies op 'n soortgelyke manier as ander alkene. In die teenwoordigheid van voldoende of oormaat suurstof, brand propaan om water en koolstofdioksied te vorm.
- 2 C3H6 + 9 O2 → 6 CO2 + 6 H2O + hitte
As daar onvoldoende suurstof is vir volledige verbranding, vind onvolledige verbranding plaas sodat koolstofmonoksied en / of roet (koolstof) ook gevorm kan word.
- C3H6 + 2 O2 → 3 H2O + 2 C + CO + hitte
Verwysings
wysig- ↑ "Propylene".
- ↑ "Duurzame bioplastics op basis van hernieuwbare grondstoffen (Volhoubare bioplastiek gebaseer op hernubare grondstowwe)". WUR (in Nederlands). 27 Augustus 2013. Besoek op 9 Desember 2020.
- ↑ "Spacecraft finds propylene on Saturn moon, Titan" (in Engels). UPI.com. 30 September 2013. Besoek op 9 Desember 2020.
- ↑ "Market Study: Propylene (2nd edition)" (in Engels). ceresana.com. Desember 2014. Besoek op 9 Desember 2020.
- ↑ Budavari, Susan, red. (1996). "8034. Propylene". The Merck Index, Twelfth Edition (in Engels). New Jersey: Merck & Co. pp. 1348–1349.
- ↑ Maggini, Giovanni (17 April 2013). "Technology Economics: Propylene via Propane Dehydrogenation, Part 3" (in Engels). Slideshare.net. Besoek op 9 Desember 2020.
- ↑ Ghashghaee, Mohammad (2018). "Heterogeneous catalysts for gas-phase conversion of ethylene to higher olefins". Rev. Chem. Eng. (in Engels). 34 (5): 595–655. doi:10.1515/revce-2017-0003. S2CID 103664623.
- ↑ Banks, R. L.; Bailey, G.C. (1964). "Olefin Disproportionation. A New Catalytic Process". Industrial & Engineering Chemistry Product Research and Development (in Engels). 3 (3): 170–173. doi:10.1021/i360011a002.
- ↑ Delaude, Lionel; Noels, Alfred F. (2005). "Metathesis". Kirk-Othmer Encyclopedia of Chemical Technology (in Engels). Weinheim: Wiley-VCH. doi:10.1002/0471238961.metanoel.a01. ISBN 978-0471238966.
- ↑ "Sasol Synfuels Pty Ltd". Bloomberg (in Engels). Besoek op 9 Desember 2020.
- ↑ Gary, James H.; Handwerk, Glenn E. (2001). Petroleum Refining: Technology and Economics (in Engels) (4de uitg.). CRC Press. ISBN 0-8247-0482-7.