Triptofaan
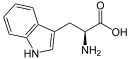
Triptofaan (afgekort as Trp of W; gekodeer deur die kodon UGG) is 'n α-aminosuur wat gebruik word in die biosintese van proteïene. Dit bevat 'n α-aminogroep, 'n α-karboksielgroep, en 'n indoolsyketting, wat dit 'n nie-polêre aromatiese aminosuur maak. Dit is noodsaaklik in die mens, want die liggaam kan dit nie sintetiseer nie: dit moet uit die dieet verkry word. Triptofaan is ook 'n voorloper van die neurotransmitter serotonien en die hormoon melatonien.[1]
|
Algemeen | |
|---|---|
| Naam | Triptofaan |
| IUSTC-naam | Triptofaan of (2S)-2-amino-3-(1H-indool-3-yl)propanoësuur |
 |
|
| Chemiese formule | C4H9O3N1 |
| Molêre massa | g/mol |
| CAS-nommer | 73-22-3 |
| Fasegedrag | |
| Smeltpunt | |
| Kookpunt | |
| Digtheid | |
| Oplosbaarheid | 0.23 g/L by 0 °C, 11.4 g/L by 25 °C, |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Soos ander aminosure is triptofaan 'n zwitterioon by fisiologiese pH: die aminogroep is geprotoneer (–NH3+; pKa = 9.39) en die karboksielgroep is gedeprotoneer ( –COO−; pKa = 2.38).[2]
Ontdekking
wysigDie isolering van triptofaan is vir die eerste keer deur Frederick Hopkins in 1901 berig.[3] Hopkins het triptofaan uit gehidroliseerde kaseïen herwin, en kon 4-8 g triptofaan uit 600 g ongeprosesseerde kaseïen verkry.[4]
Biosintese en industriële produksie
wysigAs 'n noodsaaklike aminosuur, word triptofaan nie uit eenvoudiger stowwe by die mens en ander diere gesintetiseer nie, so dit moet teenwoordig wees in die dieet in die vorm van triptofaan-bevattende proteïene. Plante en mikro-organismes sintetiseer normaalweg triptofaan uit sjikimiensuur of antranilaat:[5] antranilaat kondenseer met fosforibosielpirofosfaat, met pirofosfaat as 'n neweproduk. Die ribosering word geopen en onderwerp aan reduktiewe dekarboksilering, en indool-3-gliserolfosfaat word gevorm; hierdie, op sy beurt, word in indool omgesit. In die laaste stap kataliseer triptofaansintase die vorming van triptofaan uit indool en die aminosuur serien.
Die industriële produksie van triptofaan is ook 'n biosintetiese, en is gebaseer op die fermentasie van serien en indool deur bakterieë soos B. amyloliquefaciens, B. subtilis, C. glutamicum of E. coli. Partykeer word geneties gemodifiseerde bakterië gebruik. Die bakterië wat gebruik word het almal mutasies die heropname van aromatiese aminosure verhoed, of wat veelvuldige of ooruitgedrukte trp operons het.[6][7][8]
Funksie
wysigAminosure, insluitend triptofaan, is boustene vir proteïensintese, en proteïene is nodig om lewe te onderhou. Baie diere (insluitend die mens) kan nie triptofaan sintetiseer nie: hulle moet dit in hulle dieet kry, wat dit 'n noodsaaklike aminosuur maak. Triptofaan is een van die minder algemene aminosure in proteïene, maar dit speel 'n belangrike strukturele of funksionele rolle waar dit voorkom. Triptofaan- en tirosienresidue speel byvoorbeeld 'n spesiale rol in die "ankering" van membraanproteïene in die selmembraan. Daarbenewens funksioneer triptofaan as 'n biochemiese voorloper vir die volgende verbindings:
- Serotonien ('n senuoordraer), gesintetiseer deur triptofaan hidroksilase.[9][10]
- Melatonien ('n neurohormoon) word op sy beurt uit serotonien gesintetiseer, met behulp van die N-asetieltransferase en 5-hidroski-indool-O-metieltransferase ensieme.[11]
- Niasien, ook bekend as vitamien B3, word vanaf triptofaan gesintetiseer via kinurenien- en kinoliensuur.[12]
- Auxins ('n klas van fitohormone) word uit triptofaan gesintetiseer.[13]
Fruktosewanabsorpsie veroorsaak onvoldoende absorpsie van triptofaan in die dunderm, verminderde vlakke van triptofaan in die bloed,[14] en depressie.[15]
In bakterieë wat triptofaan sintetiseer, aktiveer hoë sellulêre vlakke van die aminosuur 'n repressor proteïen, wat bind aan die trp operon.[16] Binding van hierdie repressor aan die triptofaanoperon verhoed transkripsie van die stroomaf DNA wat kodeer vir die ensieme wat betrokke is by die biosintese van triptofaan. Hoë vlakke van triptofaan voorkom dus triptofaansintese deur middel van 'n negatiewe terugvoer lus, en wanneer die sel se triptofaan vlakke weer afneem, word transkripsie van die tvp operon hervat. Hierdie meganisme laat streng gereguleerde en vinnige reaksie op veranderinge in die sel se interne en eksterne triptofaanvlakke toe.
Triptofaanmetabolisme deur menslike mikrobiota
|
Aanbevole dieettoelae
wysigIn 2002 het die Amerikaanse Instituut van Medisyne 'n Aanbevole Dieettoelaag (ADT) van 5 mg/kg liggaamsmassa/dag van triptofaan vir volwassenes 19 jaar en ouer voorgestel.[21]
Bronne
wysigTriptofaan is teenwoordig in die meeste proteïen-gebaseerde voedsel. Dit is veral volop in sjokolade, hawer, gedroogde dadels, melk, jogurt, maaskaas, rooi vleis, eiers, vis, pluimvee, sesam, kekerertjies, amandels, sonneblomsade, pampoenpitte, bokwiet, spirulina, en grondboontjies. In teenstelling met die algemene opvatting[22] dat kalkoenvleis baie triptofaan bevat, is die triptofaaninhoud in kalkoen tipies van pluimvee.[23]
| voedsel | Triptofaan [g/100 g voedsel] |
Proteïen [g/100 g voedsel] |
Triptofaan/Proteïen [%] |
|---|---|---|---|
| eierwit, gedroog | 1.00 | 81.10 | 1.23 |
| spirulina, gedroog | 0.93 | 57.47 | 1.62 |
| kabeljou, atlanties, gedroog | 0.70 | 62.82 | 1.11 |
| sojabone, rou | 0.59 | 36.49 | 1.62 |
| kaas, Parmesaan | 0.56 | 37.90 | 1.47 |
| sesamsaad | 0.37 | 17.00 | 2.17 |
| kaas, cheddar | 0.32 | 24.90 | 1.29 |
| sonneblomsaad | 0.30 | 17.20 | 1.74 |
| varkvleis, tjop | 0.25 | 19.27 | 1.27 |
| Kalkoenvleis | 0.24 | 21.89 | 1.11 |
| hoendervleis | 0.24 | 20.85 | 1.14 |
| beesvleis | 0.23 | 20.13 | 1.12 |
| hawer | 0.23 | 16.89 | 1.39 |
| salm | 0.22 | 19.84 | 1.12 |
| lam, tjop | 0.21 | 18.33 | 1.17 |
| baars, Atlantiese oseaan | 0.21 | 18.62 | 1.12 |
| kekerertjies, rou | 0.19 | 19.30 | 0.96 |
| eier | 0.17 | 12.58 | 1.33 |
| koring meel, wit | 0.13 | 10.33 | 1.23 |
| bak sjokolade, onversoet | 0.13 | 12.9 | 1.23 |
| melk | 0.08 | 3.22 | 2.34 |
| rys, wit, medium-graan, gaar | 0.028 | 2.38 | 1.18 |
| quinoa, rou | 0.167 | 14.12 | 1.2 |
| quinoa, gaar | 0.052 | 4.40 | 1.1 |
| aartappels, rooibruin | 0.02 | 2.14 | 0.84 |
| tamarinde | 0.018 | 2.80 | 0.64 |
| piesang | 0.01 | 1.03 | 0.87 |
Kalkoenvleis en lomerigheid
wysig'n Algemene opvatting in die VSA is dat lomerigheid by inname van te veel kalkoenvleis met hoë vlakke van triptofaan in kalkoen verbind kan word.[25][26] Die hoeveelheid triptofaan in kalkoenlveis is egter vergelykbaar met dié van ander vleis. Lomerigheid na ete kan veroorsaak word deur ander voedsel wat saam met die kalkoen geëet word, veral koolhidrate.[27] Na 'n maaltyd wat ryk aan koolhidrate is, word insulien vrygestel.[28][29][30] Insulien stimuleer op sy beurt die inname van groot neutrale vertakte syketting aminosure, maar nie triptofaan nie, deur spierweefsel, wat daartoe lei dat die verhouding van triptofaan tot vertakte aminosure in die bloedstroom verhoog word. Die gevolglike verhoogde triptofaan verhouding verminder kompetisie by die groot neutrale aminosuur transportproteïen wat aminosure met vertakte en aromatiese sykettings oor membrane skuif, veral in die kapillêre bloedvate van die bloed–brein skans, sodat meer triptofaan oorgedra word in die serebrospinale vog.[31][32] Sodra dit in die serebrospinale vog is, word triptofaan in die raphe kerne deur die normale ensiematiese pad in serotonien omgesit,[33] wat verder in die pineaalklier in melatonien omgesit word. Na-ete lomerigheid kan dus die gevolg wees van 'n swaar maaltyd ryk aan koolhidrate en proteïen, wat indirek die produksie van melatonien in die brein verhoog, en daardeur slaap bevorder.
Gebruik as 'n dieet aanvulling
wysigOmdat triptofaan omgeskep word in 5-hidroskitriptofaan (5-HTP) wat dan omskep word in die neurotransmitter serotonien, is daar al voorgestel dat die gebruik van triptofaan of 5-HTP depressiesimptome kan verlig deur die vlak van serotonien in die brein te verhoog. Triptofaan word oor die toonbank in die Verenigde State van Amerika verkoop, nadat dit tussen 1989 en 2005 meer of minder sterk gekontroleer is, en in die Verenigde Koninkryk as 'n dieetaanvulling met die veronderstelling dat dit as 'n antidepressant, angswerende middel, of slaapmiddel sou werk. Dit is ook in beskikbaar in sommige Europese lande as 'n voorskrifmedikasie vir die behandeling van depressie. Alhoewel bloedvlakke van triptofaan waarskynlik nie verander word deur die veranderings in die dieet nie,[34][35] maar inname van suiwer triptofaan verhoog die vlak van serotonien in die brein.[36] Dit is omdat die stelsel wat triptofaan oor die bloed-brein skans vervoer, ook ander aminosure vervoer wat in voedsel voorkom. Hoë bloedplasmavlakke van ander groot neutrale aminosure verhoed dat die plasmakonsentrasie van triptofaan bydra tot die verhoging van die triptofaankonsentrasie in die brein.[37]
In 2001 is 'n Cochrane Reviews artikel gepubliseer oor die effek van 5-HTP en triptofaan op depressie. Slegs hoë kwaliteit studies op 5-HTP en triptofaan is ingesluit. Van die 108 studies wat tussen 1966 en 2000 gepubliseer is, het net twee voldoen aan die kwaliteitstandaarde vir insluiting, met 'n totaal van 64 mense wat deelgeneem het. Die stowwe was meer effektief as plasebo, maar die skrywers se opsomming was dat die getuienis onvoldoende was op 'n sterk gevolgtrekking te maak, en dat ander antidepressante bestaan wat doeltreffend en veilig is, wat die kliniese nut van 5-HTP en triptofaan beperk.[38] Die gebruik van triptofaan as 'n bykomende terapie tot die standaardbehandeling vir gemoed- en angsversteurings word tans nie ondersteun nie.[39]
Newe-effekte
wysigMoontlike newe-effekte van triptofaan sluit in naarheid, diarree, lomerigheid, lighoofdigheid, hoofpyn, droë mond, versteurde visie, verdowing, euforie, en nystagmus (onwillekeurige oogbewegings).[40][41]
Interaksies
wysigOmdat triptofaan nog nie deeglik bestudeer is in 'n kliniese omgewing nie, is sy interaksies met ander middels nog nie goed bekend nie. Wanneer triptofaan geneem word as 'n dieet aanvulling, het dit die potensiaal om serotoniensindroom te veroorsaak wanneer dit gekombineer word met antidepressante van die MAOI of SSRI klasse of met ander sterk serotonergiese middels.
Navorsing
wysigIn 1912 het Felix Ehrlich getoon dat gis die natuurlike aminosure in wese aanval deur koolstofdioksied af te splyt, en die amino groep met hidroksiel te vervang. Deur hierdie reaksie word triptofaan in triptofol omgeskakel.[42]
Triptofaan beïnvloed serotoniensintese in die brein wanneer mondelings in 'n gesuiwerde vorm toegedien word, en word dus gebruik om serotonienvlakke vir navorsingsdoeleindes te verander. Lae serotonienvlakke in die brein kan veroorsaak word deur lae-triptofaan diete.[43] Studies wat hierdie metode gebruik het, het bevind dat serotonien aggressie verminder en welgevalligheid verhoog.[44]
Fluoressensie
wysigTriptofaan is 'n belangrike intrinsieke fluoressensie-peiler, wat gebruik kan word om die aard van die mikro-omgewing rondom die triptofaanresidu te bepaal. Meeste van die intrinsieke fluoressensie van 'n gevoude proteïen is as gevolg van triptofaan residue.
Veiligheid
wysigEosinofilie–mialgie sindroom
wysigDaar was 'n groot uitbraak van eosinofilie-mialgie sindroom in die VSA in 1989, met meer as 1500 gevalle wat aan die CDC gerapporteer is en ten minste 37 sterftes.[45] Na die voorlopige ondersoek aan die lig gebring het dat die uitbraak aan triptofaan gekoppel kan wees, het die Food and Drug Administration (FDA) triptofaan-dieetaanvullings in 1989 teruggeroep en meeste verkope aan die publiek in 1990 verbied:[46][47] ander lande het hierdie voorbeeld gevolg.[48][49]
Die daaropvolgende epidemiologiese studies het die sindroom gekoppel aan spesifieke lotte van L-triptofaan wat deur 'n enkele groot Japannese vervaardiger, Showa Denko, afkomstig was.[50][51][52] Dit het uiteindelik duidelik geword dat die lotte besmet is deur spoor onsuiwerhede, wat verdink is om verantwoordelik te wees vir die 1989 uitbraak.[53][54] Daar is egter ook getuienis daarvoor dat triptofaan self 'n belangrike bydraende faktor in die sindroom kan wees.[55]
Die FDA het sy beperkinge op die verkope en bemarking van triptofaan in Februarie 2001 gedeeltelik gelig, maar het voortgegaan om die invoer van triptofaan wat nie vir 'n gemagtige gebruik bestemis, tot en met 2005 te beperk.[56]
Die feit dat die Showa Denko fasiliteit geneties gemanipuleerde bakterieë gebruik het om die besmette lotte van L-triptofaan te produseer is aangehaal as stawing vir noue monitering van die chemiese suiwerheid van produkte wat van biotegnologie afkomstig is.[57] Die fokus op hierdie aspek deur teenstaanders van genetiese manipulasie is ook gekritiseer, omdat die genetiese manipulasie nie die oorsaak van die kontaminasie was nie.[58]
Verwysings
wysig- ↑ Slominski A, Semak I, Pisarchik A, Sweatman T, Szczesniewski A, Wortsman J (Januarie 2002). "Conversion of L-tryptophan to serotonin and melatonin in human melanoma cells". FEBS Letters. 511 (1–3): 102–6. doi:10.1016/s0014-5793(01)03319-1. PMID 11821057.
- ↑ "L-tryptophan | C11H12N2O2 - PubChem". pubchem.ncbi.nlm.nih.gov. Besoek op 22 Desember 2016.
- ↑ Hopkins FG, Cole SW (Desember 1901). "A contribution to the chemistry of proteids: Part I. A preliminary study of a hitherto undescribed product of tryptic digestion". The Journal of Physiology. 27 (4–5): 418–28. doi:10.1113/jphysiol.1901.sp000880. PMC 1540554. PMID 16992614.
- ↑ Cox GJ, King H (1943). "L-Tryptophane". Org. Synth. 2: 612–616. doi:10.15227/orgsyn.010.0100.
- ↑ Radwanski ER, Last RL (Julie 1995). "Tryptophan biosynthesis and metabolism: biochemical and molecular genetics". The Plant Cell. 7 (7): 921–34. doi:10.1105/tpc.7.7.921. PMC 160888. PMID 7640526.
- ↑ Ikeda M (2002). "Amino acid production processes". Advances in Biochemical Engineering/Biotechnology. Advances in Biochemical Engineering/Biotechnology. 79: 1–35. doi:10.1007/3-540-45989-8_1. ISBN 978-3-540-43383-5. PMID 12523387.
- ↑ Becker J, Wittmann C (Augustus 2012). "Bio-based production of chemicals, materials and fuels -Corynebacterium glutamicum as versatile cell factory". Current Opinion in Biotechnology. 23 (4): 631–40. doi:10.1016/j.copbio.2011.11.012. PMID 22138494.
- ↑ Conrado RJ, Varner JD, DeLisa MP (Oktober 2008). "Engineering the spatial organization of metabolic enzymes: mimicking nature's synergy". Current Opinion in Biotechnology. 19 (5): 492–9. doi:10.1016/j.copbio.2008.07.006. PMID 18725290.
- ↑ Fernstrom JD (April 1983). "Role of precursor availability in control of monoamine biosynthesis in brain". Physiological Reviews. 63 (2): 484–546. PMID 6132421.
- ↑ Schaechter JD, Wurtman RJ (November 1990). "Serotonin release varies with brain tryptophan levels" (PDF). Brain Research. 532 (1–2): 203–10. doi:10.1016/0006-8993(90)91761-5. PMID 1704290. Geargiveer vanaf die oorspronklike (PDF) op 9 Augustus 2020. Besoek op 1 November 2017.
- ↑ Wurtman RJ, Anton-Tay F (1969). "The mammalian pineal as a neuroendocrine transducer" (PDF). Recent Progress in Hormone Research. 25: 493–522. doi:10.1016/b978-0-12-571125-8.50014-4. PMID 4391290. Geargiveer vanaf die oorspronklike (PDF) op 31 Mei 2014. Besoek op 1 November 2017.
- ↑ Ikeda M, Tsuji H, Nakamura S, Ichiyama A, Nishizuka Y, Hayaishi O (Maart 1965). "Studies on the biosynthesis of nicotinamide adenine dinucleotide. II. A role of picolinic carboxylase in the biosynthesis of nicotinamide adenine dinucleotide from tryptophan in mammals". The Journal of Biological Chemistry. 240 (3): 1395–401. PMID 14284754. Geargiveer vanaf die oorspronklike op 13 Oktober 2008. Besoek op 1 November 2017.
- ↑ Palme K, Nagy F (April 2008). "A new gene for auxin synthesis". Cell. 133 (1): 31–2. doi:10.1016/j.cell.2008.03.014. PMID 18394986.
- ↑ Ledochowski M, Widner B, Murr C, Sperner-Unterweger B, Fuchs D (April 2001). "Fructose malabsorption is associated with decreased plasma tryptophan" (PDF). Scandinavian Journal of Gastroenterology. 36 (4): 367–71. doi:10.1080/003655201300051135. PMID 11336160. Geargiveer vanaf die oorspronklike (PDF) op 19 April 2016. Besoek op 1 November 2017.
- ↑ Ledochowski M, Sperner-Unterweger B, Widner B, Fuchs D (Junie 1998). "Fructose malabsorption is associated with early signs of mental depression". European Journal of Medical Research. 3 (6): 295–8. PMID 9620891.
- ↑ Gollnick P, Babitzke P, Antson A, Yanofsky C (2005). "Complexity in regulation of tryptophan biosynthesis in Bacillus subtilis". Annual Review of Genetics. 39: 47–68. doi:10.1146/annurev.genet.39.073003.093745. PMID 16285852.
- ↑ 17,0 17,1 17,2 17,3 17,4 17,5 17,6 17,7 17,8 Zhang LS, Davies SS (April 2016). "Microbial metabolism of dietary components to bioactive metabolites: opportunities for new therapeutic interventions". Genome Med. 8 (1): 46. doi:10.1186/s13073-016-0296-x. PMC 4840492. PMID 27102537.
- ↑ Wikoff WR, Anfora AT, Liu J, Schultz PG, Lesley SA, Peters EC, Siuzdak G (Maart 2009). "Metabolomics analysis reveals large effects of gut microflora on mammalian blood metabolites". Proc. Natl. Acad. Sci. U.S.A. 106 (10): 3698–3703. doi:10.1073/pnas.0812874106. PMC 2656143. PMID 19234110.
IPA metabolisme diagram - ↑ "3-Indolepropionic acid". Human Metabolome Database. University of Alberta. Besoek op 12 Oktober 2015.
- ↑ Chyan YJ, Poeggeler B, Omar RA, Chain DG, Frangione B, Ghiso J, Pappolla MA (Julie 1999). "Potent neuroprotective properties against the Alzheimer beta-amyloid by an endogenous melatonin-related indole structure, indole-3-propionic acid". J. Biol. Chem. 274 (31): 21937–21942. doi:10.1074/jbc.274.31.21937. PMID 10419516.
- ↑ Institute of Medicine (2002). "Protein and Amino Acids". Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Washington, DC: The National Academies Press. pp. 589–768.
- ↑ Ballantyne C (21 November 2007). "Does Turkey Make You Sleepy?" (in Engels). Scientific American. Geargiveer vanaf die oorspronklike op 11 Desember 2013. Besoek op 6 Junie 2013.
- ↑ Joanne Holden, Nutrient Data Laboratory, Agricultural Research Service. "USDA National Nutrient Database for Standard Reference, Release 22" (in Engels). United States Department of Agriculture. Geargiveer vanaf die oorspronklike op 14 April 2016. Besoek op 29 November 2009.
{{cite web}}: AS1-onderhoud: meer as een naam (link) - ↑ Rambali B, Van Andel I, Schenk E, Wolterink G, van de Werken G, Stevenson H, Vleeming W (2002). "[The contribution of cocoa additive to cigarette smoking addiction]" (PDF). RIVM. The National Institute for Public Health and the Environment (Netherlands) (report 650270002/2002).
- ↑ Helmenstine AM. "Does Eating Turkey Make You Sleepy?" (in Engels). About.com. Geargiveer vanaf die oorspronklike op 27 Desember 2016. Besoek op 13 November 2013.
- ↑ McCue K. "Chemistry.org: Thanksgiving, Turkey, and Tryptophan" (in Engels). Geargiveer vanaf die oorspronklike op 4 April 2007. Besoek op 17 Augustus 2007.
- ↑ "Food & mood. (neuroscience professor Richard Wurtman) (Interview)". Nutrition Action Healthletter. HighBeam Research. September 1992. Geargiveer vanaf die oorspronklike op 1 Julie 2017.
- ↑ Lyons PM, Truswell AS (Maart 1988). "Serotonin precursor influenced by type of carbohydrate meal in healthy adults" (PDF). The American Journal of Clinical Nutrition. 47 (3): 433–9. PMID 3279747.
- ↑ Wurtman RJ, Wurtman JJ, Regan MM, McDermott JM, Tsay RH, Breu JJ (Januarie 2003). "Effects of normal meals rich in carbohydrates or proteins on plasma tryptophan and tyrosine ratios". The American Journal of Clinical Nutrition. 77 (1): 128–32. PMID 12499331.
- ↑ Afaghi A, O'Connor H, Chow CM (Februarie 2007). "High-glycemic-index carbohydrate meals shorten sleep onset". The American Journal of Clinical Nutrition. 85 (2): 426–30. PMID 17284739.
- ↑ Pardridge WM, Oldendorf WH (Augustus 1975). "Kinetic analysis of blood-brain barrier transport of amino acids". Biochimica et Biophysica Acta. 401 (1): 128–36. doi:10.1016/0005-2736(75)90347-8. PMID 1148286.
- ↑ Maher TJ, Glaeser BS, Wurtman RJ (Mei 1984). "Diurnal variations in plasma concentrations of basic and neutral amino acids and in red cell concentrations of aspartate and glutamate: effects of dietary protein intake". The American Journal of Clinical Nutrition. 39 (5): 722–9. PMID 6538743.
- ↑ Fernstrom JD, Wurtman RJ (Desember 1971). "Brain serotonin content: increase following ingestion of carbohydrate diet". Science. 174 (4013): 1023–5. doi:10.1126/science.174.4013.1023. PMID 5120086.
- ↑ Soh NL, Walter GT (2011). "Tryptophan and depression: can diet alone be the answer?". Acta Neuropsychiatrica VL. 23 (1): 1601–5215, . doi:10.1111/j.1601-5215.2010.00508.x.
{{cite journal}}: AS1-onderhoud: ekstra leestekens (link) - ↑ "Effects and side effects associated with the non-nutritional use of tryptophan by humans". The Journal of Nutrition. 142 (12): 2236S–2244S. Desember 2012. doi:10.3945/jn.111.157065.
- ↑ "Precursor control of neurotransmitter synthesis". Pharmacological Reviews. 32 (4): 315–35. Desember 1980.
- ↑ "Frameshift mutation in exon 3 of the lipoprotein lipase gene causes a premature stop codon and lipoprotein lipase deficiency". Molecular Biology & Medicine. 7 (6): 511–7. Desember 1990.
- ↑ "Tryptophan and 5-hydroxytryptophan for depression". The Cochrane Database of Systematic Reviews (1): CD003198. 2002. doi:10.1002/14651858.CD003198.
- ↑ "Complementary and alternative therapies as add-on to pharmacotherapy for mood and anxiety disorders: a systematic review". Journal of Affective Disorders. 150 (3): 707–19. September 2013. doi:10.1016/j.jad.2013.05.042.
- ↑ "Summary of workshop discussions on establishing upper limits for amino acids with specific attention to available data for the essential amino acids leucine and tryptophan". The Journal of Nutrition. 142 (12): 2245S–2248S. Desember 2012. doi:10.3945/jn.112.160846.
- ↑ "Dietary supplement drug therapies for depression". Journal of Psychosocial Nursing and Mental Health Services. 50 (6): 13–6. Junie 2012. doi:10.3928/02793695-20120508-06.
- ↑ "A synthesis of tryptophol" (PDF). Journal of Biological Chemistry. 88 (3): 659–662. 1930.
- ↑ "Acute tryptophan depletion in humans: a review of theoretical, practical and ethical aspects". Journal of Psychiatry & Neuroscience. 38 (5): 294–305. September 2013. doi:10.1503/jpn.120209.
- ↑ "The effect of raising and lowering tryptophan levels on human mood and social behaviour". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 368 (1615): 20110375. 2013. doi:10.1098/rstb.2011.0375.
- ↑ Allen, J.A. (2014). "Eosinophilia–Myalgia Syndrome". Encyclopedia of Toxicology (3rd uitg.). Burlington: Elsevier Science. ISBN 978-0-12-386455-0.
- ↑ http://www.cfsan.fda.gov/~dms/ds-tryp1.html.
- ↑ http://www.webmd.com/vitamins-and-supplements/l-tryptophan-uses-and-risks#1.
- ↑ Castot, A (1991). "["Eosinophilia-myalgia" syndrome due to L-tryptophan containing products. Cooperative evaluation of French Regional Centers of Pharmacovigilance. Analysis of 24 cases]". Therapie. 46 (5): 355–65.
- ↑ https://cot.food.gov.uk/sites/default/files/cot/tryptophanamend200401.pdf.
- ↑ "Eosinophilia-myalgia syndrome associated with exposure to tryptophan from a single manufacturer". JAMA. 264 (2): 213–7. Julie 1990. doi:10.1001/jama.264.2.213.
- ↑ "Risk factors for developing eosinophilia myalgia syndrome among L-tryptophan users in New York". The Journal of Rheumatology. 20 (4): 666–72. April 1993.
- ↑ "Tryptophan produced by Showa Denko and epidemic eosinophilia-myalgia syndrome". The Journal of Rheumatology. Supplement. 46: 81–8, discussion 89–91. Oktober 1996.
- ↑ "Characterization of "peak E," a novel amino acid associated with eosinophilia-myalgia syndrome". Science. 250 (4988): 1707–8. Desember 1990. doi:10.1126/science.2270484.
- ↑ "Identification of substances formed by decomposition of peak E substance in tryptophan". Food and Chemical Toxicology. 30 (1): 71–81. Januarie 1992. doi:10.1016/0278-6915(92)90139-C.
- ↑ "A heretofore undisclosed crux of eosinophilia-myalgia syndrome: compromised histamine degradation". Inflammation Research. 54 (11): 435–50. November 2005. doi:10.1007/s00011-005-1380-7.
- ↑ Allen, JA (November 2011). "Post-epidemic eosinophilia-myalgia syndrome associated with L-tryptophan". Arthritis and rheumatism. 63 (11): 3633–9.
- ↑ "Eosinophilia-myalgia syndrome and tryptophan production: a cautionary tale". Trends in Biotechnology. 12 (9): 346–52. September 1994. doi:10.1016/0167-7799(94)90035-3.
- ↑ "Does medical mystery threaten biotech?". Science. 250 (4981): 619. November 1990. doi:10.1126/science.2237411.
Verdere leesstof
wysig- Wood RM, Rilling JK, Sanfey AG, Bhagwagar Z, Rogers RD (Mei 2006). "Effects of tryptophan depletion on the performance of an iterated Prisoner's Dilemma game in healthy adults". Neuropsychopharmacology. 31 (5): 1075–84. doi:10.1038/sj.npp.1300932. PMID 16407905.
- Sturtz R (2009). "what is the difference between L-Tryptophan and 5-HTP?". The Lidtke letter: 1. Geargiveer vanaf die oorspronklike op 8 Desember 2013. Besoek op 1 November 2017.
Eksterne skakels
wysig- "KEGG PATHWAY: Tryptophan metabolism - Homo sapiens". KEGG: Kyoto Encyclopedia of Genes and Genomes. 23 Augustus 2006. Besoek op 20 April 2008.
- G. P. Moss. "Tryptophan Catabolism (early stages)". Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB). Besoek op 20 April 2008.
- G. P. Moss. "Tryptophan Catabolism (later stages)". Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB). Besoek op 20 April 2008.
- B. Mikkelson; D. P. Mikkelson (22 November 2007). "Turkey Causes Sleepiness". Urban Legends Reference Pages. Snopes.com. Besoek op 20 April 2008.