Berillium
| ||||||||||||||||||||||||||||
| Algemeen | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Naam, simbool, getal | berillium, Be, 4 | |||||||||||||||||||||||||||
| Chemiese reeks | aardalkalimetale | |||||||||||||||||||||||||||
| Groep, periode, blok | 2, 2, s | |||||||||||||||||||||||||||
| Atoommassa | 9,0121831(5) g/mol | |||||||||||||||||||||||||||
| Elektronkonfigurasie | 2s2 | |||||||||||||||||||||||||||
| Elektrone per skil | 2, 2 | |||||||||||||||||||||||||||
| CAS-registernommer | 7440-41-7 | |||||||||||||||||||||||||||
| Fisiese eienskappe | ||||||||||||||||||||||||||||
| Toestand | vastestof | |||||||||||||||||||||||||||
| Smeltpunt | 1 560 K (1 287 °C) | |||||||||||||||||||||||||||
| Kookpunt | 2 742 K (2 469 °C) | |||||||||||||||||||||||||||
| Digtheid | (0 °C, 101.325 kPa) 1,85 g/L | |||||||||||||||||||||||||||
| Voorkoms | 
| |||||||||||||||||||||||||||
| Atoomeienskappe | ||||||||||||||||||||||||||||
| Oksidasietoestande | +2, +1[1] | |||||||||||||||||||||||||||
| Ionisasie-energieë | 1ste: 899,5 kJ/mol | |||||||||||||||||||||||||||
| 2de: 1 757,1 kJ/mol | ||||||||||||||||||||||||||||
| 3de: 14 848,7 kJ/mol | ||||||||||||||||||||||||||||
| Atoomradius | 112 pm | |||||||||||||||||||||||||||
| Kovalente radius | 96 pm | |||||||||||||||||||||||||||
| Van der Waals-radius | 153 pm | |||||||||||||||||||||||||||
| Kristalstruktuur | heksagonaal, dig gepak 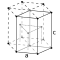
| |||||||||||||||||||||||||||
| Verdampingswarmte | 292,40 kJ/mol | |||||||||||||||||||||||||||
| Smeltingswarmte | 12,20 kJ/mol | |||||||||||||||||||||||||||
| Spoed van klank | 12 890 m/s | |||||||||||||||||||||||||||
| Elektronegatiwiteit | 1,57 (Skaal van Pauling) | |||||||||||||||||||||||||||
| Warmtekapasiteit | (25 °C) 1 825 J/(mol·K) | |||||||||||||||||||||||||||
| Termiese geleidingsvermoë | (300 K) 31.3 106 W/(m·K) | |||||||||||||||||||||||||||
| Geskiedenis | ||||||||||||||||||||||||||||
| Ontdek | 1798 | |||||||||||||||||||||||||||
| Ontdek deur | Louis Nicolas Vauquelin | |||||||||||||||||||||||||||
| Vernaamste isotope | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Portaal | ||||||||||||||||||||||||||||
Berillium is die chemiese element in die periodieke tabel met die simbool Be en atoomgetal van 4.
Dis 'n giftige bivalente element, 'n aardalkalimetaal met 'n staalgrys kleur, en is sterk met 'n lae gewig, dog baie bros. Berillium word hoofsaaklik benut as verhardingsmiddel in allooie (mees algemeen, berillium-koper legerings).
Kenmerkende eienskappe
wysigBerillium het een van die hoogste smeltpunte van die ligte metale. Die elastisiteitsmodulus van berillium is ongeveer 'n derde groter as die van staal. Dit het 'n uitstekende termiese geleidingsvermoë, is nie-magneties en weerstaan gekonsentreerde salpetersuur. Dit is hoogs deurlaatbaar vir X-strale en neutrone word vrygestel wanneer dit deur alfapartikels getref word, soos vanaf radium of polonium (omtrent 30 neutrone/miljoen alfa partikels). By standaard temperatuur en druk weerstaan berillium oksidasie wanneer dit aan lig blootgestel word (die vermoë van berillium om glas te krap spruit egter waarskynlik toe te skryf aan 'n dun lagie oksied wat op die oppervlak vorm.
Toepassings
wysig- Berllium is vir 'n lang tyd gebruik as 'n legeringsmiddel vir die produksie van berillium koper. (Be het die vermoë om groot hoeveelhede hitte te absorbeer.) Koperberillium-allooie word in 'n wye verskeidenheid toepassings benut as gevolg van hulle elektriese, termiese en nie-magnetiese eienskappe, asook vir hulle hoë sterkte, hardheid, goeie korrosiebestandheid en swigweerstand (Engels: fatigue resistance). Hierdie toepassings sluit in die maak van: stiksweis elektrodes, Vere, vonkwerende gereedskap en elektriese kontakte.
- Vanweë hulle stewigheid, ligte gewig en dimensionele stabiliteit oor 'n wye reeks temperature, word berillium-koper allooie ook ingespan in militêre, lug- en ruimtevaart industrieë as 'n liggewig strukturele materiaal in hoë snelheid vliegtuie, missiele, ruimte vaartuie en kommunikasie satelliete.
- Dun velle berilliumfoelie word gebruik in die X-straal waarneming diagnostiek om sigbare lig uit te filter en slegs X-strale waar te neem.
- In die veld van X-straal-litografie word berillium gebruik vir die reproduksie van mikroskopiese geïntegreerde stroombane.
- Omdat dit 'n lae absorbsiedeursneë vir termiese neutrone het, gebruik die kernkragindustrie die metaal in kernreaktore as 'n neutronreflektor en -moderator.
- Berillium word ook gebruik vir die maak van giroskope, verskeie rekenaartoerusting, horlosievere en instrumente waar ligte gewig, onbuigsaamheid en dimensionele stabiliteit belangrik is.
- Berilliumoksied is nuttig in baie aanwendings wat 'n uitstekende geleier van warmte verg met 'n hoë sterkte en hardheid en 'n baie hoë smeltpunt en wat as 'n elektriese isoleerder kan dien.
- Berillium verbindings was eens gebruik vir fluoreserende ligbuise, maar die gebruik is gestaak weens die voorkoms van berilliose in die werkers wat die buise vervaardig het (sien hieronder).
- Die James Webb-ruimteteleskoop het 'n berilliumspieël. Omdat die JWST aan temperature van so laag as -240 grade Celsius (30 kelvin) blootgestel gaan word, is die spieël van berillium gemaak omdat dit uiterse koue beter kan hanteer as glas. Berilium krimp heelwat minder en vervorm minder as glas – en bly dus eenvormiger – by sulke temperature.
Geskiedenis
wysigDie naam berillium kom van die Griekse woord beryllos vir beril. Eens was berillium ook glucinium (van Griekse woord glykys vir soet) vanweë die soet smaak van sy soute.
Die element is in 1798 ontdek in die oksiedvorm in beril en in smarag deur Louis Vauquelin. Friedrich Wöhler en A.A.Bussy het die metaal onafhanklik van mekaar geïsoleer in 1828 deur kalium met berilliumchloried te reageer.
Voorkoms
wysigBerillium word gevind in 30 verskillende minerale, die belangrikste waaronder bertrandiet, beril, chrysoberil en phenasiet tel. Edelgesteentes van beril is akwamaryn en smarag. Die belangrikste kommersiële bronne van berillium en sy verbindings is beril en bertrandiet. Tans word die grootste hoeveelheid van die metaal geproduseer deur berilliumfluoried te reduseer met magnesium. Berillium metaal het eers teen 1957 geredelik beskikbaar geword.
Isolering
Isotope
wysigBerillium het slegs een stabiele isotoop, Be-9. Kosmogenies word berillium (Be-10) geskep in die aarde se atmosfeer deur splitsing van suurstof en stikstof deur kosmiese strale. Aangesien berillium geneig is om op te los by pH vlakke van ongeveer 5.5 (reënwater se pH is tipies minder as 5), sal dit na die aarde se oppervlak gevoer word deur die reënwater. Aangesien die water vinnig alkalies word wanneer oor die oppervlak vloei, presipiteer dit vinnig uit die oplossing. Kosmogeniese Be-10 akkumuleer sodoende op die grond oppervlak, waar sy relatiewe lang halfleeftyd (1.5 miljoen jaar) 'n lang retensietyd verseker alvorens dit na B-10 (Boor verval. Be-10 en mede-produkte is al gebruik om gronderosie, grond formasie en rotsvorming te bestudeer. 'n Prentjie van kan ook gevorm word van die sonvlek aktiwiteit in die verlede asook van die ouderdom van yskerne.
Die feit dat Be-7 en Be-8 onstabiel is het verreikende kosmologiese gevolge aangesien dit beteken dat elemente swaarder as berillium nie geproduseer kon word deur kernfusie tydens die Groot knal nie. Verder is die kern energie vlakke van berillium-8 sodanig dat koolstof geproduseer kan word binne in sterre wat lewe moontlik maak. (Sien trippel-alfa proses en groot knal nukleoonsintese.
Voorsorgmaatreëls
wysigBerillium en sy soute is giftige verbindings en is potensieel karsinogenies. Kroniese berilliose is 'n long- en sistemiese granulomasiekte wat veroorsaak word deur blootstelling aan berillium. Akute berilliumsiektes in die vorm van chemiese longontsteking is die eerste keer in 1933 in Europa waargeneem en in die Verenigde State in 1943. Gevalle van kroniese berilliose is vir die eerste keer omvattend beskryf in 1946 toe werkers in 'n aanleg wat fluoreserende lampe in Massachusetts vervaardig het daarmee gediagnoseer is. Kroniese berilliose se simptome is baie soortgelyk aan sarkoidose en dit is dus moeilik om te onderskei tussen die twee kwale.
Ten spyte van die feit dat berilliumverbindings in fluoroserende ligbuise gestaak is in 1949, bestaan die risiko van blootstelling aan berillium nog steeds in die kern en lug- en ruimtevaart industrieë asook tydens die raffinering van berillium metaal en die smelt van berillium bevattende legerings, die vervaardiging van elektroniese toestelle en die hantering van ander berillium bevattende materiale.
Vroeëre navorsers het berillium en sy verskeie verbindings geproe vir soetheid om die teenwoordigheid daarvan te bevestig. Moderne analitiese toerustig maak dit onnodig om hierdie onveilige te gebruik en daar moet geensins gepoog word om die stof in te neem nie. Berillium en sy verbindings moet met groot sorg gehanteer word wanneer aktiwiteite onderneem word wat tot die vorming van berillium stof kan lei (longkanker is 'n moontlike gevolg van langdurige blootstelling aan berillium belaaide stof).
Die stof kan veilig gehanteer word solank as sekere prosedures gevolg word. Geen poging moet aangewend word om met berillium te werk alvorens daar vereenselwig is met die hanteringsprosedures nie.
Gesondheidsuitwerking
wysigBerillium kan skadelik wees wanneer dit ingeasem word. Die uitwerking daarvan hang af van die tydperk van blootstelling. As berilliumvlakke in die lug hoog genoeg is (> 1000 μg/m³), kan 'n akute toestand ontwikkel genaamd akute berilliumsiekte, wat baie ooreenkoms toon met longontsteking. Bedryfs- en gemeenskapstandaarde vir lugkwaliteit is effektief in die voorkoming van akute longskade.
Sommige mense (1-15%) raak sensitief vir berilium. Hierdie individue mag ook ontstekingsreaksies ontwikkel in die asemhalingstelsel. Die toestand word kroniese berilliumsiekte genoem en kan eers baie jare na blootstelling aan hoër as normale vlakke berillium (groter as 0.2 μg/m³) voorkom. Die siekte veroorsaak moegheid, swakheid en swaar asemhaling. Dit kan lei tot anoreksie, gewigsverlies en mag ook lei tot die vergroting van die regterkant van die hart in gevorderde gevalle. Sommige mense wat gesensiteer is vir berillium mag nie die simptome toon nie. Dit is onwaarskynlik dat die algemene bevolking akute of kroniese berilliumsiekte sal ontwikkel aangesien berilliumvlakke in die lug normaalweg baie laag is (0.00003-0.0002 μg/m³).
Die insluk van berillium het nog geen uitwerking getoon op mense nie aangesien baie min berillium vanuit die maag en ingewande geabsorbeer word. Maagswere is waargeneem in honde met 'n dieet wat berillium bevat. Berilliumkontak met vel wat skraap- of snymerke het, mag 'n uitslag of swere tot gevolg hê.
Langtermyn-blootstelling aan berillium vergroot die risiko om longkanker te ontwikkel. Die Verenigde State se Department of Health and Human Services (DHHS) en die Internasionale Agentskap vir kankernavorsing (IARC) het bepaal dat berillium 'n karsinogeniese stof is. Die Verenigde State se Environmental Protection Agency (EPA) het bepaal dat berillium 'n moontlike menslike karsinogeen is. Volgens die EPA kan 'n leeftydlange blootstelling van 0.04 μg/m³ berillium lei tot 'n een in duisend kans om longkanker te ontwikkel.
Daar is geen studies om die gesondheidsuitwerking op kinders wat aan berillium blootgestel is, gedoen nie. Dit is waarskynlik dat die uitwerking soortgelyk sal wees as dié op volwassenes.
Berillium kan gemeet word in die urine en bloed. Die hoeveelheid berillium in bloed of urine kan aandui hoe lank en hoeveel die blootstelling was. Berilliumvlakke kan ook gemeet word in long- en velmonsters.
Vlakke waartoe industrieë tipies toegelaat word om in die lug te laat is tipies in die orde van 0.01 μg/m³, oor 'n gemiddeld van 'n 30-dae periode, of 2 μg/m³ in 'n werkskamer vir 'n agt ure skof periode.
Verwysings
wysig- ↑ "Beryllium: Beryllium(I) Hydride compound data" (PDF). bernath.uwaterloo.ca. Geargiveer vanaf die oorspronklike (PDF) op 2 Desember 2007. Besoek op 10 Desember 2007.
Bron
wysigEksterne skakels
wysig| Wikimedia Commons bevat media in verband met Beryllium. |
| Sien berillium in Wiktionary, die vrye woordeboek. |
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Alkalimetale | Aardalkalimetale | Lantaniede | Aktiniede | Oorgangsmetale | Hoofgroepmetale | Metalloïde | Niemetale | Halogene | Edelgasse | Chemie onbekend |
